*仅供医学专业人士阅读参考诚信优配
NMOSD合并时如何两头兼顾?
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是一种以视神经和脊髓受累为主的中枢神经系统自身免疫性炎性疾病[1]。研究显示,约5%~15%的NMOSD患者合并肿瘤,包括、肺癌、胸腺瘤等,患者首次发生NMOSD的中位年龄为51岁(范围18~87岁),此类患者可被诊断为副肿瘤性NMOSD[2]。
副肿瘤性NMOSD的治疗需同时针对肿瘤和NMOSD进行干预。然而,肿瘤细胞表面存在AQP4抗原表达,可与AQP4抗体发生免疫反应,同时治疗NMOSD的硫唑嘌呤、吗替麦考酚酯等免疫抑制药物可能增加恶性肿瘤风险[1,2],这些因素显著增加了治疗的复杂性。如何在治疗过程中兼顾肿瘤与NMOSD?本文将分享一例68岁NMOSD男性患者的诊治经历。患者因腹部及双下肢麻木伴乏力急性起病,症状进行性加重。11个月前确诊食管中下段鳞癌并规律接受化疗。确诊为AQP4抗体阳性NMOSD后,急性期接受激素冲击治疗,但麻木及乏力症状无明显改善甚至持续进展。缓解期序贯萨特利珠单抗治疗后,患者未再复发,麻木、疼痛症状明显好转,双下肢肌力恢复。
病例介绍
患者男,68岁。因“腹部及双下肢麻木肿胀3日”于2025年4月11日就诊。
现病史:2025年4月8日,患者无明显诱因出现腹部及双下肢麻木、肿胀感,胸部束带感,伴双下肢乏力,扶拐可自行行走,大便解出困难,小便次数多但量少。症状逐渐加重,4月12日已不能扶拐行走,4月14日腹胀更为明显,腰背部束带感及双腿疼痛加重。
既往史:确诊食管中下段鳞癌11月,2024年5月14日开始给予根治性放疗,PTV 60Gy/30F/2Gy,2024年8月15日开始接受“替吉奥1天2次 1次3粒”方案治疗,体重近半年下降约5kg。脊柱后突畸形,未诊治。
查体:双下肢肌力4-级,双下肢肌张力稍低,胸8以下针刺觉、运动觉、振动觉减退,双下肢腱反射(-),双侧病理征(+)。2天后再次查体示双下肢肌力3级,肌张力减低,胸7以下针刺觉、运动觉、振动觉减退。
辅助检查:血沉、C反应蛋白、肿瘤标志物、甲状腺功能、风湿免疫性抗体均未见明显异常。脑脊液常规示白细胞计数12×10^6/L↑,血清AQP4抗体阳性(1:32),HLA-B27(+)。B超示膀胱残余尿量约403ml↑。下肢肌电图未见异常,双侧视觉诱发电位P100延迟,四肢体感诱发电位示上肢N20潜伏期轻度延长、波幅正常,下肢P40潜伏期轻度延长、波幅偏低。2025年4月14日完善胸椎MRI平扫+增强扫描示中上段胸髓异常信号,伴轻微强化(图1)。
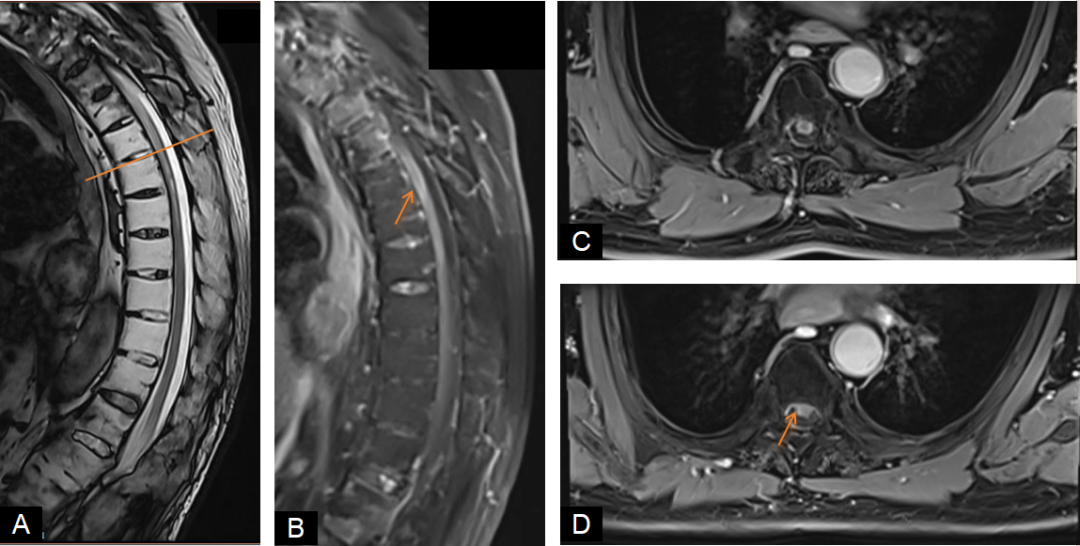
图1 2025年4月14日胸椎MRI A图:T1增强矢状位、B图:T2矢状位、C~D图:T1增强横断位示中上段胸髓异常信号,伴轻微强化
结合临床症状、生物标志物结果、胸椎MRI影像学表现及电生理检测结果,患者考虑NMOSD可能性大。2025年4月15日开始予以甲泼尼龙240mg/d静滴后患者自觉胸部束带感及双下肢无力较前好转,但查体示感觉平面无变化,双下肢肌力无变化。4月17日甲泼尼龙自500mg/d起始序贯减量,患者左侧肢体麻木较前好转,右侧麻木无改善,右下肢肌力减弱持续进展至1级。为进一步改善症状、预防NMOSD复发,患者于5月7日开始接受萨特利珠单抗皮下注射规律治疗,首次注射当日患者即诉胸腹束带感减轻、腹胀好转。6月4日第3次注射时患者胸背疼痛、束带感好转,双下肢肌力恢复至3级。7月3日复查血AQP4抗体滴度1:10,较前(1:32)下降,后续随访未再复发。
病例讨论
本病例描述了一例68岁NMOSD男性患者的诊治经过。患者急性起病,主要表现为胸段平面以下感觉、运动、自主神经功能障碍,症状呈进行性发展,血清AQP4抗体阳性,脑脊液细胞数轻度增高,视觉诱发电位及体感诱发电位提示视神经及深感觉传导异常,胸椎核磁提示胸段脊髓病变,最终确诊为AQP4抗体阳性NMOSD。急性期经激素冲击治疗后患者症状无明显好转,反而持续进展。缓解期序贯萨特利珠单抗规律皮下注射,束带感、肢体麻木及疼痛无力症状快速、显著好转,血清AQP4抗体滴度较前下降。
本例患者的特殊性在于,其于NMOSD发病前11个月确诊食管中下段鳞癌,接受放疗后规律接受化疗。NMOSD是一种自身免疫性炎性疾病,近年来越来越多的研究表明,炎症和免疫在肿瘤的发生、发展以及治疗反应中扮演着至关重要的角色。炎症反应不仅可以影响肿瘤细胞所处的微环境,还能与肿瘤细胞以及各种免疫细胞相互作用,从而促进或抑制肿瘤的生长和转移[3]。
IL-6作为一种多效性细胞因子,不仅在机体整体的炎症反应、免疫应答、造血调控等病理生理过程中扮演重要角色,在NMOSD中于外周促进浆母细胞存活并增加AQP4抗体分泌、促进Th17细胞分化,增加血脑屏障通透性并使AQP4抗体和促炎细胞进入中枢,在中枢神经系统激活并放大炎症级联反应,损伤神经组织,还在肿瘤的发生、发展及免疫逃逸中扮演重要角色,并且与肿瘤患者的预后关系密切[4-6]。
在促进肿瘤增殖方面,IL-6在多种肿瘤(如肝癌、乳腺癌、卵巢癌、食管鳞癌等)中高度表达,其信号通路主要通过经典途径(IL-6R/gp130复合体)激活STAT3,继而上调Bcl-2、Cyclin D1等抗凋亡和促增殖基因;在血管生成方面,IL-6还通过诱导(VEGF)的表达促进肿瘤新生血管的形成,改善肿瘤微环境供氧和营养,从而为肿瘤细胞提供适宜的生长环境;在免疫逃逸方面,以本例患者合并的食管鳞癌为例,IL-6/STAT3被肿瘤细胞利用以抑制其凋亡,并使得食管鳞癌细胞逃逸免疫监视。有研究发现,IL-6、STAT3均为食管鳞癌的独立不良预后因子[3,5-7]。基于IL-6在肿瘤发生发展的重要作用,目前已开展动物与临床试验探索IL-6R抑制剂在治疗肿瘤中的潜力。研究表明,IL-6R抑制剂治疗可降低小鼠模型TNBC术后肿瘤复发率和转移率[8],其可能逆转化疗耐药性,增强抗肿瘤免疫反应并限制免疫治疗的自身免疫副作用[9]。因此,阻断IL-6信号通路在控制副肿瘤性NMOSD病理进展、疾病活动性乃至延缓疾病进展中具备治疗潜力。
本例患者在首次发作NMOSD后接受激素冲击治疗,症状持续进展。为尽快改善症状、预防复发,予以萨特利珠单抗规律治疗。该药物长期治疗时感染风险较低诚信优配,相较于传统免疫抑制剂无肿瘤发生风险[10-12]。自2025年5月初(距起病约1月)启动萨特利珠单抗治疗后,患者NMOSD未再复发,肢体麻木、无力等临床症状明显改善,AQP4抗体滴度较前下降,期间未出现明显不良反应,提示抗IL-6R疗法对于此类患者具备良好疗效与安全性。
专家述评
本例合并食管鳞癌的AQP4抗体阳性NMOSD病例,为副肿瘤性NMOSD的临床诊疗提供了极具价值的实践范本,同时凸显了抗IL-6R疗法在NMOSD特殊人群中的突破意义。NMOSD与肿瘤共病时,传统免疫抑制剂面临“控制疾病”与“致癌风险”的两难境地,而IL-6作为连接自身免疫炎症反应与肿瘤进展的关键枢纽,其信号通路的异常激活既是NMOSD神经损伤的推手,也是肿瘤增殖、血管生成、免疫逃逸的助力。这一病理机制的交叉性使得靶向IL-6信号通路的萨特利珠单抗具备了“双向获益”的治疗潜力。
从本例患者治疗结果来看,萨特利珠单抗不仅快速缓解了患者脊髓受累引发的感觉、运动及自主神经功能障碍,更凭借其低感染风险、无肿瘤诱发风险的特性,规避了传统免疫抑制剂对肿瘤患者的潜在威胁,实现了两种疾病的治疗平衡。这一实践不仅验证了萨特利珠单抗在副肿瘤性NMOSD中的疗效与安全性,更为此类“自身免疫性疾病-肿瘤”共病患者的治疗开辟了新路径,为后续临床决策与研究提供了重要参考。
调研问题
专家简介

黄月 教授
主任医师,医学博士,硕士生导师,二级教授,河南省人民医院神经免疫性疾病专科主任
中国免疫学会神经免疫分会委员会委员
中国卒中学会免疫分会委员会委员
中国卒中学会脑静脉病变分会委员会常务委员
中国神经科学学会神经毒素分会委员会常务委员
河南省医师协会神经内科分会副会长
河南省医学会神经病学分会神经免疫学组组长
河南省医师协会神经病学分会免疫学组副组长
河南省免疫学会神经免疫专业委员会副主任委员
河南省卒中学会免疫分会副主任委员
河南省研究型医院学会神经免疫与感染专委会副主任委员
专家简介

贺爽 副主任医师
河南省人民医院神经内科副主任医师
神经病学博士
亚专科方向:神经退行性疾病及神经遗传性疾病
参考文献:
[1] 中华医学会神经病学分会神经免疫学组. 中国视神经脊髓炎谱系疾病诊断与治疗指南(2025版)[J]. 中华神经科杂志, 2025, 58(7): 687-703.
[2] 贺电, 蔡刚, 楚兰. 副肿瘤性视神经脊髓炎谱系疾病[J]. 中华神经科杂志, 2015,48(8):715-718.
[3] Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell. 2010 Mar 19;140(6):883-99.
[4] Fujihara K, Bennett J L, de Seze J, et al. Interleukin-6 in neuromyelitis optica spectrum disorder pathophysiology[J]. Neurol Neuroimmunol Neuroinflamm, 2020,7(5).
[5] Kishimoto T. IL-6: from its discovery to clinical applications[J]. Int Immunol, 2010, 22(5):347-352.
[6] Yu H, Pardoll D. Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3[J]. Nat Rev Cancer, 2009, 9(11):798-809.
[7] 李一达,邹丽晴,朱正飞. 食管鳞癌肿瘤微环境相关研究进展[J]. 中国癌症杂志, 2019, 29 (4): 307-312.
[8] Haq ATA, Yang PP, Jin C, et al. Immunotherapeutic IL-6R and targeting the MCT-1/IL-6/CXCL7/PD-L1 circuit to prevent relapse and metastasis of triple-negative breast cancer. Theranostics. 2024 Mar 3;14(5):2167-2189.
[9] Du, Y., Liu, X., Pan, R., et al. Tocilizumab for advanced non-small-cell lung cancer with concomitant cachexia: An observational study. Journal of Cachexia, Sarcopenia and Muscle. 2024 Nov 11.
[10] Benjamin M. Greenberg, et al. Infection in NMOSD: Analysis of infection patterns in the SAkura studies, satralizumab post-marketing data, and NMOSD US PharMetrics claims data. 2024 AAN P003.
[11] Nakashima I, Nakahara J, Yasunaga H, et al. Real-world management of patients with neuromyelitis optica spectrum disorder using satralizumab: Insights from a Japanese claims database[J]. Multiple Sclerosis and Related Disorders, 2024, 84.
*“医学界”力求所发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
辉煌配资提示:文章来自网络,不代表本站观点。